삼전사기 도전하는 바이오 기업들…코스닥 입성 가능할까
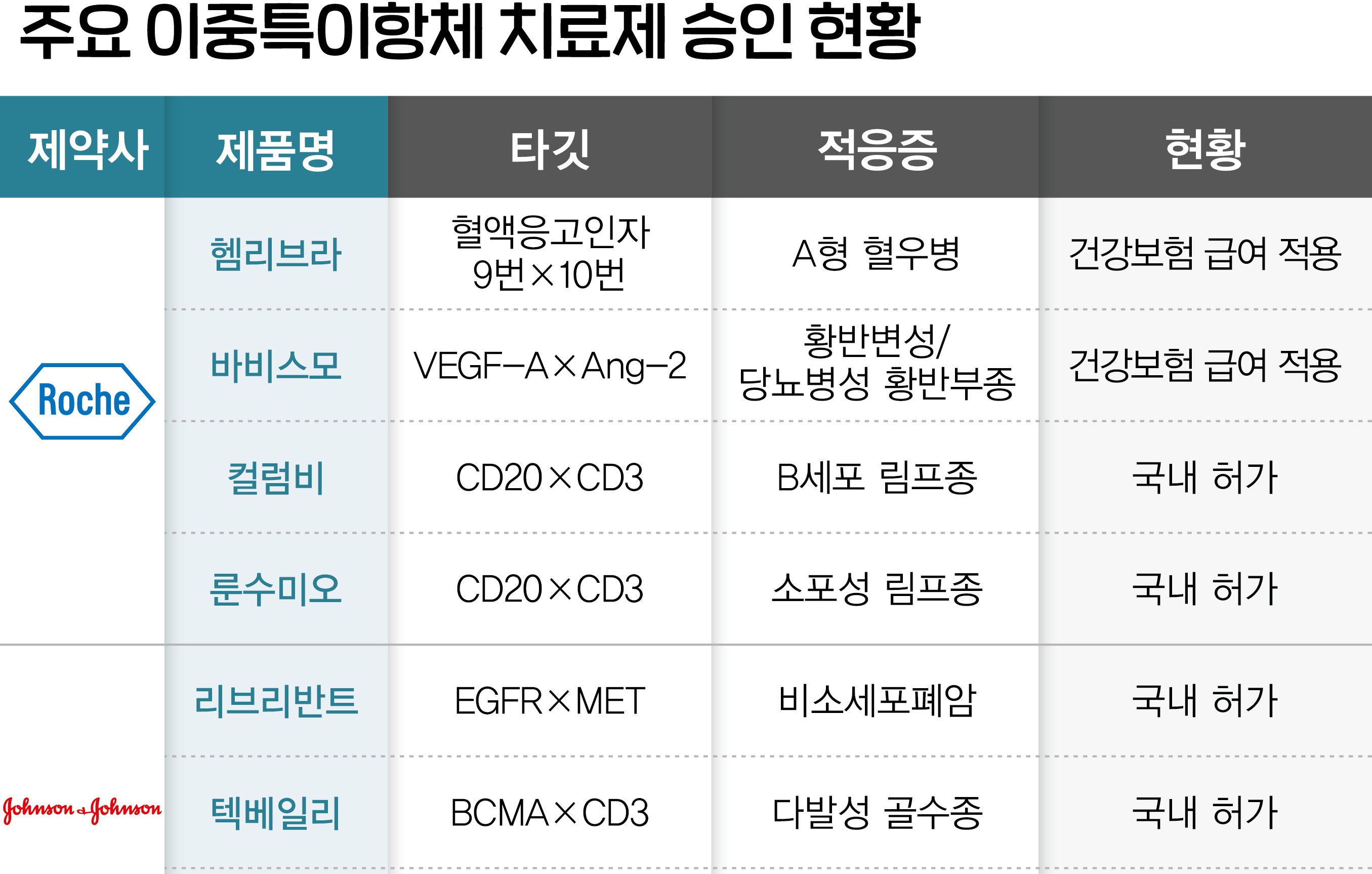
메디칼타임즈=문성호 기자지난해부터 이어진 바이오‧헬스케어 분야 투자 위축 흐름이 점차 개선되는 것일까.제약‧바이오 기업 중심으로 기술특례 상장 흐름이 되살아나고 있다. 다만, 투자업계에서는 보수적인 투자 기조 속에서 GLP-1 혹은 ADC‧이중항체 기술 기반 항암제 개발 기업에 국한된 것이라는 평가도 나온다.디앤디파마택, 이뮨온시아 기업 로고.18일 제약‧바이오업계에 따르면, 올해 들어 국내 제약‧바이오 기업을 중심으로 주식시장 상장에 도전하는 기업이 늘어나고 있다.기존 반도체‧2차 전지 주도에서 '바이오‧헬스케어‧소프트웨어'로 IPO 시장의 무게중심이 이동하고 있다는 뜻이다.실제로 최근 들어 코스닥 시장 상장을 확정하거나 재도전 끝에 기술성 평가에 성공하는 기업들이 나타나면서 기대감을 키우고 있다.대표적인 기업을 꼽는다면 '디앤디파마텍'이다. GLP-1 계열 경구용 비만/MASH(대사이상 관련 지방간염) 신약 개발 전문 바이오 기업인 디앤디파마텍은 3번째 도전만에 오는 5월 코스닥 시장 상장을 이미 예약해놓은 상태다. 특히 디앤디파마텍은 지난해 4월 미국 멧세라(Metsera)사와 경구용 비만 치료제 글로벌 라이선스 계약을 체결한 데 이어 올해 3월 기존 계약 확장 및 주사용 비만 치료제 신규 라이선스 계약까지 맺은 바 있다. 이는 총 계약 규모 약 8억불(약 1조 500억 원) 수준의 대규모 기술이전 계약이다. 다시 말해, 이 같은 기술이전 성과에 힘입어 코스닥 시장 상장에 성공한 것이다.디앤디파마텍 이슬기 대표는 "설립 초기부터 GLP-1 계열 펩타이드 신약 개발에 집중해 온 기업"이라며 "이번 코스닥 상장으로 미충족 수요가 높은 비만 및 MASH로 대표되는 대사성질환 중심으로 GLP-1 계열 펩타이드 신약의 빠른 상업화를 달성하겠다"고 밝혔다.여기에 면역항암제 전문 바이오벤처로 유한양행 자회사로 편입된 '이뮨온시아'도 3번째 도전 만에 코스닥 기술특례상장을 위한 기술성 평가를 통과했다.이뮨온시아의 주요 파이프라인 중 IMC-001(PD-L1 단클론항체)은 임상 2상 NK/T세포 림프종에서 탁월한 효능과 안전성을 입증(69% 객관적 반응률)했으며, IMC-002(2세대 CD47 단클론항체)는 임상 1a상 고형암에서 안전성을 입증한 바 있다.이 중 IMC-002는 2021년에 총 4억 7000만불(5400억원) 규모의 기술이전 계약을 맺기도 했다. 한국아이큐비아 '2024년 주목해야 할 제약업계 9가지 이슈' 주제 웨비나 발표자료 일부분이다.이뮨온시아 김흥태 대표는 "이번 기술성 평가결과를 기반으로 올해 코스닥 상장에 도전할 것"이라며 "이를 통해 현재 임상단계에 있는 핵심 파이프라인들의 개발을 가속화하고 후속 파이프라인들의 비임상 개발과 신규 후보물질 확보에도 박차를 가할 계획"이라고 말했다.이 가운데 두 기업의 경우 '3번'의 도전 끝에 코스닥 상장 혹은 기술성 평가에 통과한 공통점이 존재하지만, 'GLP-1'과 '이중항체 기술 항암제'라는 최근 제약‧바이오 치료제 개발 트렌드가 반영된 기업이라는 점이다.제약업계에서는 이러한 상황 속에 올해 제약‧바이오업계 투자 환경 개선으로 이어질지 주목해야 한다는 평가다. 한국아이큐비아 이강복 마케팅&영업담당 상무는 최근 자체 웨비나를 통해 "상장 예비심사 청구 기업 중 30곳 중 19곳이 바이오(ADC 링커 등)‧헬스케어(원격의료 등)‧소프트웨어(신약 개발용 AI 등) 업종"이라며 "바이오‧디지털헬스 기술혁신이 투자 관심사로 급부상하고 있다"고 평가했다.그는 "제약‧바이오업계 투자환경은 점차 개선될 것으로 전망하지만 중소 바이오텍의 자금난과 기술력과 무관한 퇴출 사례를 보듯 업계 내부적으로는 여전히 구조적 문제점이 상존하고 있다"고 꼬집었다.